
EFEITO DA SUPLEMENTAÇÃO COM PREBIÓTICO NA RESPOSTA IMUNE DE CAVALOS QUARTO DE MILHA DE CORRIDA
O Brasil tem o quarto maior rebanho equino do mundo, com 6 milhões de animais conforme dados estatísticos da FAO (Food and Agriculture Organization) e IBGE (Instituto Brasileiro de Geografia e Estatística) Censo Agropecuário em 31/12/2009 (CNA, 2010). O agronegócio equino é importante para a economia brasileira, pois ao todo são gerados cerca de R$ 7,3 bilhões de negócios e mais de 700 mil empregos diretos, que vão desde o treinamento de animais, venda de insumos, eventos, esportes, entre outros (CNA, 2010). A vivência entre homem e cavalo vem sofrendo grandes mudanças, coincidentes com o crescimento acentuado da equideocultura nas últimas décadas. Em consequência das mudanças na utilização dos equinos, os estudos técnicos com enfoque no cavalo atleta ganham destaque, visto que hoje é grande a criação desses animais exclusivamente para participação em eventos equestres.
A raça Quarto de Milha foi a primeira a ser desenvolvida na América. Surgiu nos Estados Unidos por volta do ano de 1600. Os primeiros exemplares da raça que a originaram foram trazidos da Arábia e Turquia à América do Norte pelos explora-dores e comerciantes espanhóis. Os garanhões escolhidos eram cruzados com éguas que vieram da Inglaterra, em 1611. O cruzamento produziu cavalos compactos,com músculos fortes, podendo correr distâncias curtas mais rapidamente do que nenhuma outra raça. Nos finais de semana, os colonizadores divertiam-se, promovendo corridas nas ruas das vilas e pelas estradas dos campos, perto das plantações, com distância de um quarto de milha (402 metros), originando o nome do ca-valo. O plantel Quarto de Milha no Brasil é composto, segundo dados fornecidos pelo Stud Book da ABQM, até 13/08/2015, por 474.862 animais registrados, representados por 95.792 proprietários. Desse número, 45.447 são criadores e 26.917 associados cadastrados, espalhados por todos os estados brasileiros. Seus haras distribuídos em aproximadamente 1 milhão de hectares, são avaliados em mais de R$ 19,8 bilhões, onde são consumidos anualmente em ração em torno de 336 mil toneladas, com gasto de cerca de R$ 370 milhões. A mão-de-obra empregada diretamente também é bastante significativa, oferecendo 380 mil empregos diretos (ABQM, 2016).
O cavalo atleta é um corredor nato, mas para apresentar resultados satisfatórios e melhorar a sua performance atlética se faz necessária a implantação de métodos de treinamento, alimentação e suplementação adequados em cada fase de sua carreira (FERRAZ, 2006). Sabe-se que o exercício físico intenso realizado durante treinamentos ou competições gera em humanos e animais variações em diversos parâmetros fisiológicos (MARQUES, 2002). Para o bom desempenho durante a realização de exercícios de alta, moderada e baixa intensidade,ocorre a exigência de um correto funcionamento dos sistemas nervoso, respiratório, cardiovascular e musculoesquelético, para que assim, seja preservada e mantida a homeostasia do organismo durante a execução dos exercícios. A participação do sistema nervoso autônomo e endócrino favorece a mobilização das reservas energéticas, controle da homeostasia cardiovascular e equilíbrio dos fluidos corporais (FOSS, 2000).
Os prebióticos são componentes alimentares não digeríveis que afetam beneficamente o hospedeiro, por estimular a proliferação ou atividade de populações de bactérias desejáveis no cólon, inibindo a multiplicação de patógenos, além de estimular a resposta imune, levando a benefícios adicionais ao organismo (ROBERFROID, 2002). Os dois principais polissacarídeos constituintes da pare-de celular das leveduras (β-D-glucanos e α-D-manano) têm sido recentemente reconhecidos como prebióticos por serem capazes de promover modulação do sistema imune de diversos organismos vivos, desde insetos a humanos, mediante interações específicas com diferentes células imunocompetentes (GARCIA, 2008). Os mananoligossacarídeos (MOS) são obtidos a partir da parede celular de leveduras (
Saccharomyces cerevisiae
).
Com o rebanho equino em ascensão, é fundamental o investimento em tecnologias para suprir as necessidades do animal de forma sustentável, minimizando efeitos colaterais da utilização destes produtos. As situações diversas nesta área têm atraído interesse dos pesquisadores em realizar estudos que possam promover aos cavalos condições propícias para o máximo desenvolvimento e desempenho.Assim, os prebióticos surgem como uma estratégia nutricional capaz de promover a manipulação da microbiota intestinal para melhorar a saúde do hospedeiro. Desta forma, o objetivo desse estudo foi avaliar a influência da adição de prebiótico MOS no incremento da resposta imune de cavalos submetidos a protocolos de treinamento físico intenso.
2. MATERIAL E MÉTODOS
O experimento foi conduzido no Jockey Clube de Sorocaba, na cocheira do treinador Rivail Rosa. Os animais permaneceram estabulados em baias individuais durante o estudo.
Foram utilizados 20 cavalos da raça Quarto de Milha, com idade média três anos e peso médio 450 kg,vermifugados e imunizados contra tétano, influenza, herpes vírus e encefalomielite.
Foram formados dois grupos experimentais compostos cada um por 10 equinos: O grupo teste recebeu suplementação com prebiótico à base de MOS via oral misturado à ração no primeiro trato da manhã, na dosagem indicada para animais em treinamento de 10g por animal por dia. A suplementação ocorreu por 90 dias. O grupo controle não recebeu a suplementação.
Os animais foram treinados todos os dias na mesma intensidade, seguindo o protocolo do treinador, sendo 30 minutos no total.
Para avaliação da resposta imune humoral específica, sessenta dias após o início da suplementação foi realizada a imunização com uma proteína de alto peso molecular (Keyholelimpethemocyanin – KLH) extraída do molusco Megathu-racrenulata que tem sido largamente utilizada como imunógeno em estudos com animais (LANCE et al., 2007). Os animais foram imunizados pela via intramuscular com 1mg de KLH (Sigma ChemicalCo, St Louis, MO) diluídos em 1 ml de água deionizada estéril.
A coleta de sangue foi realizada pela via intravenosa através da punção da veia jugular, em tubos “vacutainers” sem anticoagulante nos dia da imunização, 21, 45, e 60 dias após a imunização. As amostras foram encaminhadas imediatamente ao laboratório da UNISO. Para a separação do soro, o sangue foi centrifugado após colheita a 1500g por 5 minutos sendo o soro transferido para microtubos para posterior analise imunológica.Para dosagens de imunoglobulinas no soro foi realizado o ensaio de ELISA (Enzyme Linked Immunosorbent Assay) para verificar a presença de anticorpos IgG capazes de reconhecer a proteína KLH. Placas de poliestireno de 96 poços (NUNC, Inc. Naperville USA) foram incubadas com a preparação de KHL (1%) em tampão carbonato de sódio 0,2M, pH 9,6 (50µL/poço). Após 24 horas de incubação a 4°C, o conteúdo líquido de cada poço foi removido através de lavagens sucessivas com PBS (tampão fosfato) contendo 0,05% de Tween-20 (PBS-T/Sigma Chemical Co. St Louis, MO, USA), seguindo-se bloqueio (100µL/poço) com gelatina a 3% diluída em PBS-T, por 1 hora a 37°C, em banho maria. As placas foram lavadas uma vez com PBS-T e incubadas com as amostras do soro antes e após a imunização, em diferentes diluições na solução de bloqueio (gelatina 1%), por 2 horas a 37°C. Após 4 lavagens com PBS-T, foi incubado com anticorpos anti-IgG de equino conjugado a peroxidase (BethylLaboratories INC, Montegmory, Texas, USA) (100µL/poço). Após 1 hora de incubação a 37°C, os poços foram lavados 4 vezes com PBS-T e em seguida a reação antígeno-anticorpo foi revelada pela adição de 100µL/poço da solução reveladora [peróxido de hidrogênio 0,1% (30 vol, 19µL) (Merck S.A., Indústrias Químicas, Rio de Janeiro, BR), ortofenilenodiamina (5mg) (p/v) (Sigma), ácido cítrico 0,1M (3mL), fosfato de sódio 0,2M (3,2mL) pH 5,5 e água destilada (6,25mL)], com incubação por 10 minutos ao abrigo da luz. A reação enzi-mática foi bloqueada pela adição de 50µL de ácido sulfúrico 2M. A leitura de absorbância foi feita em comprimento de onda de 490nm em leitor automático de ELISA (Multiskan MMC/340 P, Version 2.20).
3. RESULTADOS E DISCUSSÃO
Os animais foram alimentados com alfafa e feno, além de 7 kg de ração por dia, divididos em duas refeições. A água foi consumida ad libitum.
O estudo foi realizado de acordo com o protocolo, sem intercorrências. O soro coletado antes da imunização não apresentou anticorpos capazes de reconhecer o antígeno (D0). Já 21 dias após a imunização foi possível observar a produção de anticorpos antígenos específicos em ambos os grupos, de maneira mais acentuada no grupo suplementado, porém sem apresentar diferenças estatisticamente significativas em relação aos animais do grupo controle. Até o último dia analisado, foi possível observar presença de anticorpos antígeno específicos, de maneira mais pronunciada nos animais do grupo teste (Figura 1).
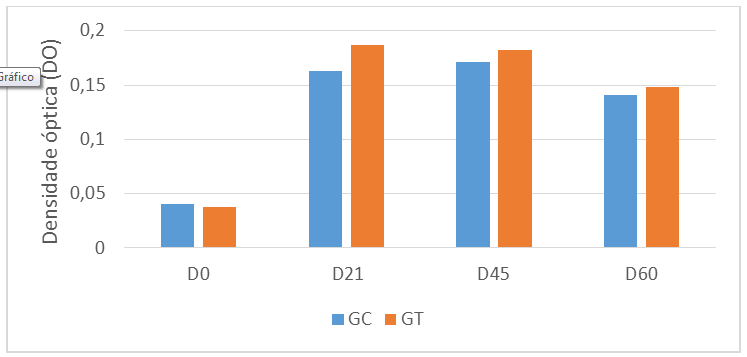
Figura 1: Representação gráfica da produção de anticorpos antes (D0) e após a imunização (D21, D45, D60) dos animais suplementados (GT) ou não com MOS (GC)
Foi possível observar a produção de anticorpos por animais de ambos os grupos, mesmo sendo submetidos a exercícios de alta intensidade, o que sugere que o treinamento proposto não influiu de maneira significativa na resposta imune adaptativa.Isso contraria observações relatadas em outros estudos nos quais se observa que o exercício de alta intensidade, com uma duração curta em seres humanos, causa uma imunossupressão transitória, com tendência a exacerbar conforme aumentam a intensidade e a duração do exercício (FERRY, et. al., 1990). Relata-se que a imunossupressão associada ao estresse é consequência do aumento na secreção do cortisol, resultado da ativação do eixo Hipotálamo-hipófise-adrenal. O cortisol diminui a proliferação de linfócitos, interfere na comunicação entre eles, inibe a migração de granulócitos e inibe a produção de anticorpos entre outros efeitos (KENDAL, et. al.,1990; MACNEIL, et. al., 1991; NIEMAN, et. al., 1992; ALVES, et. al., 2007).
Foi possível observar uma produção mais pronunciada de anticorpos nos ani-mais suplementados com o aditivo prebiótico comparado ao grupo controle. Tal resultado está de acordo com o observado por Gouveia et al., (2006) onde observaram que a suplementação diária de cães com 2 g de MOS e 2 g de FOS, conjuntamente na dieta, apresentou os melhores resultados em relação à saúde dos cães, com aumento da resposta imune local, caracterizada por uma maior produção de anticorpo.
Novos estudos serão realizados para avaliar a influência do suplemento em outros componentes da resposta imune, já que é sabido que os MOS são capazes de induzir a ativação de macrófagos, incrementando a resposta imunológica adquirida (MACARI, et. al., 2000).
CONCLUSÃO
Conclui-se que a utilização do aditivo prebiótico MOS pode incrementar a resposta imune em equinos submetidos a exercício intenso e ser uma ferramente importante para garantir a resposta imunológica dos animais que receberão a imunização.
REFERÊNCIAS BIBLIOGRÁFIAS
ABQM. Associação dos Criadores de Cavalo Quarto de Milha de Corrida. Dis-ponível em: <www.abqm.com.br/>. Acesso em 18/02/2016.
ALVES, G.J., PALERMO, N. J. Neuroimunomodulação: sobre o diálogo entre os sis-temas nervoso e imune. Revista Brasileira de Psiquiatria, v. 29 n. 4 p. 363-369, 2007.
CNA. Estudo do complexo agronegócio do cavalo. 2010. Disponível em: http://www.cepea.esalq.usp.br\pdf\cavalo_resumo.pdf. Acesso em: 22 de fevereiro de 2016.
FERRY, A; PICARD, F; DUVALLET, A; WEILL, B; RIEU, M. Changes in blood leuco-cyte populations induced by acute maximal andchronic submaximal exercise. Euro-peanJournalofAppliedPhysiology, v. 59, n. 6, p. 435-442, 1990.
FERRAZ, G. C. Respostas endócrinas, metabólicas, cardíacas e hematológicas de eqüinos submetidos ao exercício intenso e à administração de cafeína, aminofilina e clembuterol. Dissertação. UNESP, Jaboticabal, 2006.
FOSS, M.L.; KETEYIAN, S.J. Fox: Bases fisiologicas do exercicio e do esporte. 6.ed. Rio deJaneiro: Guanabara Koogan, 2000.
GARCIA, F.Suplementação alimentar com beta-glucano e mananoligossacarí-deopara tilápias do Nilo em tanques-rede. 2008. 100f. Tese (Doutorado em Aqui-cultura) – Faculdade de Ciencias Agrarias e Veterinarias, Universidade Estadual Paulista,Jaboticabal, 2008.
GOUVEIA, E.M.F. et al. Uso de mannanoligossacarídeosfosforilados (Bio-MOS(R)como adjuvante em doenças gastrointestinais em cães. Revista Pet South América,jan-fev, 2006.
KENDALL, A; HOFFMAN-GOETZ, L; HOUSTON, M; MACNEIL, B; ARUMUGAM, Y. Exercise and blood lymphocyte subset responses: intensity, duration andsubject fitness effects. Journal of Applied Physiology, v. 69, n. 1, p. 251-260, 1990.
LANCE W.; U’REN; BILLER, B. J.; ELMSLIE, R. E.; THAMM, T. H.; DOW, S. W. Evaluation of a Novel Tumor Vaccine in Dogs with Hemangiosar-coma.JournalofVeterinaryInternal Medicine, 21:113–120, 2007.
MACARI,M.; MAIORKA, A. Função gastrintestinal e seu impacto no rendimento avícola. In: CONFERÊNCIA APINCO’2000 DE CIÊNCIA E TECNOLOGIA AVÍ-COLAS, 2000. Anais... Campinas: FACTA, v.2, p.161-174, 2000.
MACNEIL, B; HOFFMAN-GOETZ, L; KENDALL, A; HOUSTON, M; ARUMUGAM, Y. Lymphocyte proliferation responses after exercise in men: fitness, intensity and duration effects. JournalofAppliedPhysiology, v. 70, n. 1, p. 179-185, 1991.
MARQUES, M.S. Influencia do exerciciofisico sobre os niveis de lactato plasmatico e cortisol serico em cavalos de corrida. 70 f. Dissertação (Mestrado em Clinica Veterinaria).Faculdadede Medicina Veterinaria e Zootecnia, Universidade de Sao Paulo, Sao Paulo. 2002.
NIEMAN, D. C.; HENSON, D. A.; JOHNSON, R.; LEBECK DAVIS, J. M.; NEHLSEN-CANNARELLA, S. L.; Effects of brief, heavy exertion on circulating lymphocyte sub-populations and proliferative response. Medicine & Science in Sports &Exercise, v. 24, n. 12, p. 1339-1345, 1992.
ROBERFROID, M.B. Functional food concept and its application to prebiot-ics.DiagnosisLiverDisease, v.34, suppl.2, p.S105-S110, 2002.
Carolina Fernanda Morais Oliveira1; Ana Carolina R. C. Porto2;Talita Ibelli 3
1Graduanda do curso de Medicina Veterinária da Universidade de Sorocaba, Sorocaba-SP
2 Professora Doutora do curso de Medicina Veterinária da Universidade de Sorocaba, Sorocaba-SP, CRMV-SP 15669.
3 Médica Veterinária gerente da linha de equinos da Univittá Saúde Animal.

Possui graduação em Medicina Veterinária pela UNIP (2002), mestrado em Biologia Celular, Molecular e Imunologia pela FMRP/USP (2005), doutorado em Clínica Médica pela FMVZ/USP (2010), Pós Doutoranda do Departamento de Reprodução Animal pela FMVZ/USP (2015) e MBA em Liderança e Gestão de Equipes pela UNISO (2018). Atualmente coordena o curso de Medicina Veterinária da Universidade de Sorocaba e se dedica a estudar os desafios da educação no século XXI e a modulação da resposta imune pelo uso da ozonioterapia. Tem experiência nas áreas de imunologia clínica, biologia celular e molecular, neonatologia e reprodução de eqüinos.
Mais artigos deste autorDescubra o mais novo lançamento da Univittá Saúde Animal: o Univittá Podcast! Conecte-se com especialistas, desvende os segredos da equinocultura e nutrição animal, e mantenha-se atualizado com o que há de mais relevante no universo dos cavalos e animais. Saiba mais!
O aminoácido vem se tornando essencial para uma alimentação excelente!




Gostou deste post? Deixe seu comentário